Glykolyse als Achillesferse von Krebs
Ein Heidelberger Team hat ein Enzym der Glykolyse als völlig neuen Angriffspunkt für die Krebstherapie identifiziert. Wird es in Tumorzellen ausgeschaltet, geht ihnen die Energie aus – ihr Wachstum verlangsamt sich.
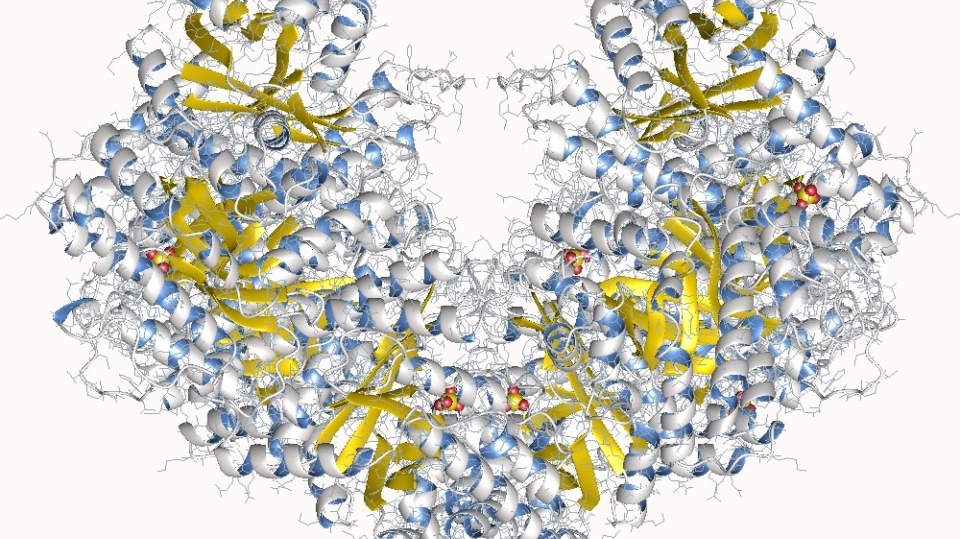
Die Glykolyse ist ein zentraler Stoffwechselweg, über den Zellen Energie aus Zucker gewinnen. Das Team um Almut Schulze vom Deutschen Krebsforschungszentrum (DKFZ) in Heidelberg hat nun in Nature Metabolism gezeigt, dass Krebszellen auf das zentrale Glykolyse- Enzym Aldolase A (ALDOA) angewiesen sind. Sein Ausschalten könnte einen neuen Ansatz für die Krebstherapie bieten.
Schon Otto Warburg zeigte vor über 100 Jahren, dass Krebszellen von der Energie aus der Glykolyse abhängig sind und selbst in Anwesenheit von Sauerstoff verstärkt Glukose zu Laktat umsetzen. Dieser „Warburg-Effekt“ sollte sie eigentlich verwundbar machen, weil die aerobe Glykolyse viel Energie kostet. Doch Krebszellen erweisen sich als anpassungsfähig und nutzen je nach Sauerstoffverfügbarkeit verschiedene Energiequellen, um sich einen Überlebensvorteil zu sichern. Mit der Aldolase A offenbart sich nun ein überraschender Schwachpunkt. Genau solche möglichen Ziele in unterschiedlichen Krebsarten zu identifizieren, darum geht es dem Heidelberger Team.
Zellen müssen in der Glykolyse erst Energie investieren, um später umso mehr Energie zurückzugewinnen. In einem genetischen Screening konnten die Wissenschaftler die Aldolase A als essentiellen Faktor für das Wachstum von Leberkrebszellen identifizieren. Schalteten sie das Enzym in den Krebszellen aus, blieb die Rückgewinnung aus – die Glykolyse verbrauchte mehr Energie als sie lieferte. Die Krebszellen gerieten somit in eine „Energiefalle“, sammelten immer mehr Fruktose-Bisphosphat an und stellten ihr Wachstum weitgehend ein, wie die Studie zeigt. Sowohl in murinen Leberkrebszellen als auch in humanen Krebszelllinien ließ sich dieser Effekt beobachten. Jedoch war dies überraschenderweise nicht der Fall, wenn die Glykolyse selbst bereits in einem frühen Schritt durch Hemmung der Glukose-6-Phosphat-Isomerase (GPI) unterbunden wurde. „Das Enzym Aldolase A ist für die Leberkrebszellen unerlässlich, obwohl der glykolytische Stoffwechselweg selbst offenbar entbehrlich ist“, so Schulze.
Das Ausschalten der Aldolase verhindert somit nicht nur die Energiegewinnung der Krebszellen durch die Glykolyse, sondern gleichzeitig ein Ausweichen auf alternative Stoffwechselwege – wie tiefergehende metabolische Analysen zeigten. Aufgrund des Warburg-Effekts nehmen diese Zellen besonders viel Glukose auf, was das Ungleichgewicht und die Ansammlung von Fruktose-Bisphosphat weiter verstärkt. Der Ansatz ließ sich auch in vivo untermauern: Wurde das Enzym bei Mäusen genetisch ausgeschaltet, reduzierte sich das Tumorwachstum und die Tiere überlebten deutlich länger. Der einzige verfügbare Hemmstoff der Aldolase A, Aldometanib, ist bisher nicht als Medikament zugelassen, könnte aber vielversprechend für die Krebstherapie sein. Ziel der weiteren Forschung ist es, hochspezifische Therapien zu ermöglichen, die gezielt die Achillesferse des Krebsstoffwechsels ausnutzen.

 Dong-Jiunn Jeffery Truong
Dong-Jiunn Jeffery Truong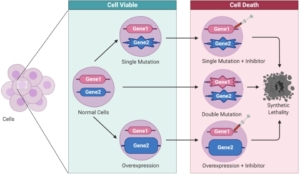 Topatana et al. (Advances in synthetic lethality for cancer therapy, J Hematol Oncol 2020, unter Lizenz CC BY 4.0)
Topatana et al. (Advances in synthetic lethality for cancer therapy, J Hematol Oncol 2020, unter Lizenz CC BY 4.0) CSEM
CSEM