
Neuartige Transportsysteme durch DNA-Nanoroboter
Mit Hilfe neu entwickelter Nanoroboter auf Basis von DNA-Origami-Strukturen lassen sich Zellmembranen gezielt manipulieren. Das vielseitige Werkzeug für die synthetische Biologie kann Kanäle für den Transport großer therapeutischer Moleküle schaffen.
Der Transport großer therapeutischer Moleküle in Zellen ist eine Herausforderung. Bisherige Ansätze wie Lipidnanopartikel oder virale Vektoren sind nicht sehr effektiv oder flexibel. Ein Forschungsteam der Universität Stuttgart hat rekonfigurierbare DNA-Nanostrukturen entwickelt, die spezielle Kanäle für den Transport großer Moleküle formen können. Diese Innovation bietet nicht nur neue Möglichkeiten für die synthetische Biologie, sondern könnte auch einen Durchbruch in der Entwicklung gezielter therapeutischer Anwendungen darstellen.
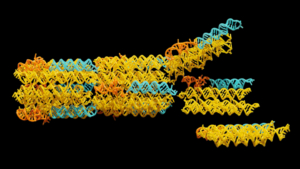
Das Forschungsteam um Laura Na Liu arbeitet mit riesigen unilamellaren Vesikeln (GUVs) – einfachen, zellgroßen Strukturen, die als Modellsystem für lebende Zellen dienen. Die Expertin für DNA-Origami hat mit Hilfe solcher speziell gefalteten Strukturen eine Art signalabhängige Nanoroboter entwickelt, die reversibel ihre Form verändern und dadurch ihre unmittelbare Umgebung im Mikrometerbereich beeinflussen können. Auf diese Weise können die entstehenden Nanostrukturen Interaktionen mit synthetischen Zellen ermöglichen und die Form und Durchlässigkeit der Lipidmembranen verändern. „Die Arbeit ist ein Meilenstein in der Anwendung der DNA-Nanotechnologie zur Regulierung des Zellverhaltens“, so Liu, Letztautorin der aktuellen Veröffentlichung im Fachmagazin Nature Materials.
Die Origami-Strukturen sind durch eine Art Klammer aus speziell entworfenen kürzeren DNA-Sequenzen quadratisch gefaltet. Durch Zugabe eines komplementären DNA-Strangs lässt sich die Nanostruktur entfalten und zum Rechteck umformen. Die zunächst frei verteilten, hochmobilen Strukturen ordnen sich dann in der Membran zu tetraedrischen Domänen an. Die Rekonfiguration der Origami-Strukturen im Nanobereich ist dabei gekoppelt an die Verformung der Modellzellen im Mikrobereich. Zusammen mit dem dann zugegebenen bakteriellen Porenprotein OmpF lassen sich so synthetische Kanäle in deren Membran bilden. Diese vergleichsweise großen Kanäle ermöglichen den Transport von Frachtmolekülen mit mehr als 70KDa. Durch Zugabe des entsprechenden DNA-Strangs lassen sich die Origami-Strukturen in ihren gefalteten Zustand zurückführen und die Kanäle so wieder verschließen – wie die Autoren mittels Rasterkraftmikroskopie nachverfolgen konnten. Laut ihnen gibt es keine biologische Entsprechung für diesen Prozess in lebenden Zellen.
Die Autoren erhoffen sich künftige biomedizinische Anwendungen für ihre flexible Plattform. Auf lebende Zellen angewendet, könnte das System die Größeneinschränkungen überwinden und den gezielten Transport von Protein-Komplexen, Enzymen oder Vesikeln direkt an die Wirkorte in der Zelle ermöglichen. Die DNA-Nanostrukturen lassen sich an verschiedene Anforderungen anpassen und könnten etwa gezielt krankhafte Zellen erkennen und deren Membran durchstoßen. Somit sollte dies erst der Auftakt zu weiteren spannenden Entwicklungen sein.

 Matthew Clarke
Matthew Clarke BioökonomieREVIER, Forschungszentrum Jülich GmbH
BioökonomieREVIER, Forschungszentrum Jülich GmbH Isaac Justice
Isaac Justice