Aicuris meldet Studienerfolg in Phase III
Die Aicuris Anti-infective Cures AG erreichte in einer zulassungsrelevanten Phase III-Studie den primären Endpunkt für ihres Wirkstoffkandidaten Pritelivir. Der Wirkstoff wurde gut vertragen und zeigte statistisch signifikant bessere Heilungsraten von Hautläsionen im Vergleich zur Standardtherapie.
Das Wuppertaler Biopharmaunternehmen Aicuris Anti-infective Cures AG hat in seiner zulassungsrelevanten Phase III-Studie den primären Endpunkt für den Wirkstoffkandidaten Pritelivir erreicht. Das antivirale Mittel zeigte bei immungeschwächten Patienten mit therapieresistenten Herpes-simplex-Virus-(HSV)-Infektionen eine statistisch signifikant bessere Heilungsrate von Hautläsionen im Vergleich zur Standardtherapie (p=0,0047 nach 28 Tagen; p<0,0001 nach 42 Tagen).
Der Wirkstoff wurde in der Studie gut vertragen und wies ein günstiges Sicherheitsprofil auf. Die vollständigen Studiendaten sollen auf einem wissenschaftlichen Kongress vorgestellt und Grundlage für Zulassungsanträge bei der US-amerikanischen Arzneimittelbehörde FDA und weiteren Behörden weltweit werden.
#### aktuelle Neuigkeien von Aicuris hier ######
Neuer Wirkmechanismus für eine schwer behandelbare Patientengruppe
Pritelivir ist ein oral verfügbares antivirales Molekül, das den Helikase-Primase-Komplex des Herpes-simplex-Virus blockiert und damit die Virusvermehrung an einem früheren Punkt der Replikation hemmt als herkömmliche Nukleosidanaloga wie Acyclovir oder Foscarnet. Der entscheidende Vorteil: Der Wirkmechanismus erfordert keine Aktivierung durch virale Enzyme und bleibt damit auch gegen resistente HSV-Stämme wirksam.
Für immungeschwächte Patienten, etwa nach Organtransplantationen oder unter Krebs- oder Immuntherapie, besteht hier ein erheblicher medizinischer Bedarf. In dieser Gruppe können HSV-Infektionen schwer verlaufen, sich über Wochen oder Monate hinziehen und mit Schmerzen, Entzündungen und erhöhter Hospitalisierungsrate einhergehen. Bestehende Therapien wie Foscarnet müssen intravenös verabreicht werden, sind oft schlecht verträglich und können Nieren- und Elektrolytstörungen verursachen. Eine wirksame, sichere und orale Behandlungsoption gilt daher als wesentlicher Fortschritt.
„Seit Jahrzehnten gab es keine Innovation in der HSV-Therapie für diese Patientengruppe“, erklärte Prof. Genovefa Papanicolaou vom Memorial Sloan Kettering Cancer Center. „Pritelivir hat das Potential, das Leben vieler Betroffener nachhaltig zu verbessern.“
Schätzungen zufolge sind zwei Drittel der Weltbevölkerung unter 50 Jahren mit dem Typ 1 (HSV-1) infiziert, der hauptsächlich für Lippenherpes verantwortlich ist. Genitalherpes, hauptsächlich verursacht durch HSV-1 oder HSV-2, betrifft etwa 13 % der Menschen im Alter von 15–49 Jahren, was 520 Millionen Menschen weltweit entspricht. Die afrikanische Region hat die höchste Verbreitung und neue Infektionen, insbesondere bei HSV-2. Der Wirkstoff von Aicuris richtet sich gegen beide Subgruppen von HSV.
Nächster Schritt: Zulassungsvorbereitung
Insgesamt nahmen 158 immungeschwächte Patienten an der internationalen, offenen Vergleichsstudie teil, die in 15 Ländern durchgeführt wurde. Der positive Ausgang der Studie markiert für Aicuris einen wichtigen Meilenstein auf dem Weg zur Marktzulassung. Das Unternehmen plant, den Zulassungsantrag 2026 einzureichen. „Nach über 20 Jahren in der Infektionsforschung ist dies ein entscheidender Moment“, sagte Larry Edwards, CEO von Aicuris. „Mit Pritelivir könnten wir erstmals eine orale, gut verträgliche Therapie anbieten, die auch bei resistenten HSV-Stämmen wirkt.“
Mit zunehmender Zahl immunsupprimierter Menschen – infolge von Transplantationen, Krebs- und Autoimmunerkrankungen – wächst der Bedarf an gezielten antiviralen Therapien. Aicuris, das bereits den CMV-Präventivwirkstoff Prevymis® (in Lizenz bei MSD) entwickelt hat, positioniert sich mit Pritelivir als Spezialist für Infektionskrankheiten bei immungeschwächten Patientengruppen. In einer Phase I-Studie befindet sich der weitere Wirkstoff AIC468, der die gefürchtete BK-Virus-Infektion bei Nierentransplantation unterdrücken soll, die regelmäßig zur Abstoßung des Transplantats führt. Sollte sich die Überlegenheit von Pritelivir in der endgültigen Datenauswertung für die Zulassung bestätigen, könnte der Wirkstoff einen Paradigmenwechsel in der Behandlung refraktärer HSV-Infektionen einleiten – ein Feld, in dem bislang kaum therapeutische Fortschritte erzielt wurden.
Auch Pritelivir stammt wie der bereits von Aicuris durch die Zulassung bekommene Wirkstoff Letermovir ursprünglich von Bayer Healthcare, deren Wuppertaler Infektionsforschung Prof. Helga Rübsamen-Schaeff von 1994 bis 2004 leitete – dann stieß Bayer den gesamten Indiaktionsbereich ab, Rübsamen-Schaeff sicherte sich mit einigen Ex-Bayer-Kollegen wie Holger Zimmermann ein gutes Dutzend von bisher unter Bayer-Flagge entwickelten Wirkstoffkandidaten und gründete 2006 Aicuris.
Aus einer der Bayer-Substanzen wurde bereits ein erfolgreiches Medikament: Letermovir, ein Hemmstoff gegen das Cytomegalievirus. Bricht dieses Virus beispielsweise bei Knochenmarktransplantationen aus, führt es schnell zum Tod. Eine Gefahr, die das Wuppertaler Medikament erheblich eindämmen kann, das nun von MSD vermarktet wird. Hierfür gab es auch von Bundespräsident Frank-Walter Steinmeier bereits Lob: Er verlieh Helga Rübsamen-Schaeff und Holger Zimmermann im November den mit 250.000 Euro dotierten Deutschen Zukunftspreis 2018.

 Aicuris AG
Aicuris AG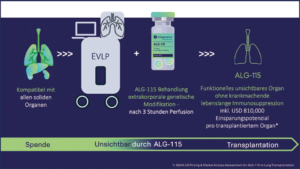 Allogenetics
Allogenetics Cutiss AG, Frank Brüderli
Cutiss AG, Frank Brüderli