Einzelne Aminosäuren im Nanomaßstab
Ein Forschungsteam der TU Braunschweig hat verschiedene Methoden kombiniert, um ein Rastertunnelmikroskop für die Oberflächenanalyse von Peptiden nutzbar zu machen.
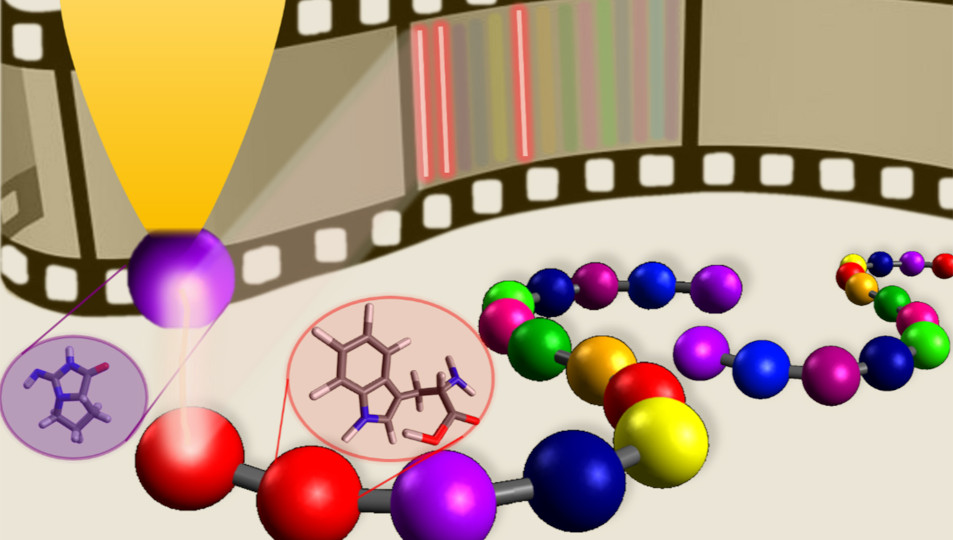
Mit einem Methoden-Mix gelang es einem Team der Technischen Universität Braunschweig erstmals, einzelne Aminosäuren in einem Peptid durch eine mikroskopische Analyse der Moleküloberfläche zu identifizieren. Damit kann jetzt einer der Grundbausteine des Lebens auf den Nanometer genau untersucht werden.
Der Unterschied von Peptid zu Protein wirkt etwas willkürlich gewählt und hängt ausschließlich von der Größe ab: Solange nicht mehr als etwa 100 Aminosäuren zusammen eine Kette bilden, ist es ein Peptid. Sobald es mehr werden, spricht die Fachwelt von Proteinen. In biologischen Prozessen tauchen die Peptide an allen möglichen Stellen auf – etwa als Hormon oder als Antibiotikum. Doch wie Peptide genau funktionieren, ist bisher nur in Ansätzen erforscht.
Normalerweise können Rastertunnelmikroskope verschiedene Elemente einer molekularen Struktur nicht unterscheiden. Im Rahmen des Exzellenzclusters QuantumFrontiers kombinierte das Team um Physikerin Schlickum verschiedene Methoden, um ein Rastertunnelmikroskop für die Peptid-Erkennung nutzbar zu machen. Dabei arbeiteten die Braunschweiger unter anderem mit dem Max-Planck-Institut für Festkörperforschung in Stuttgart zusammen. Den Forschern gelang es, die Messspitze des bildgebenden Geräts chemisch sensitiv zu machen und so auf eine der Aminosäuren im Peptid zu spezialisieren. Mit dieser neuartigen Spitze sind erstmals einzelne Aminosäuren der komplexen biologischen Ketten unter dem Mikroskop sicht- und identifizierbar. Damit, so die Wissenschaftler, sei ein erster Schritt für die Sequenzierung von Peptiden auf Oberflächen bei höchster räumlicher Auflösung erreicht.
Im Fachjournal „Nature Communications“ berichtet das Team über das neue Messverfahren.


 www.istockphoto.com/baranozdemir
www.istockphoto.com/baranozdemir Allexxandar - Freepik.com
Allexxandar - Freepik.com Rebecca Spiecker, KIT
Rebecca Spiecker, KIT