Gen-Editoren intelligent verpackt
Wissenschaftler von Helmholtz Munich und der Technischen Universität München haben eine Technologie entwickelt, um molekulare Werkzeuge zur Gen-Editierung mit Hilfe von virusähnlichen Partikeln deutlich effizienter als bisher in Zellen einzuschleusen.
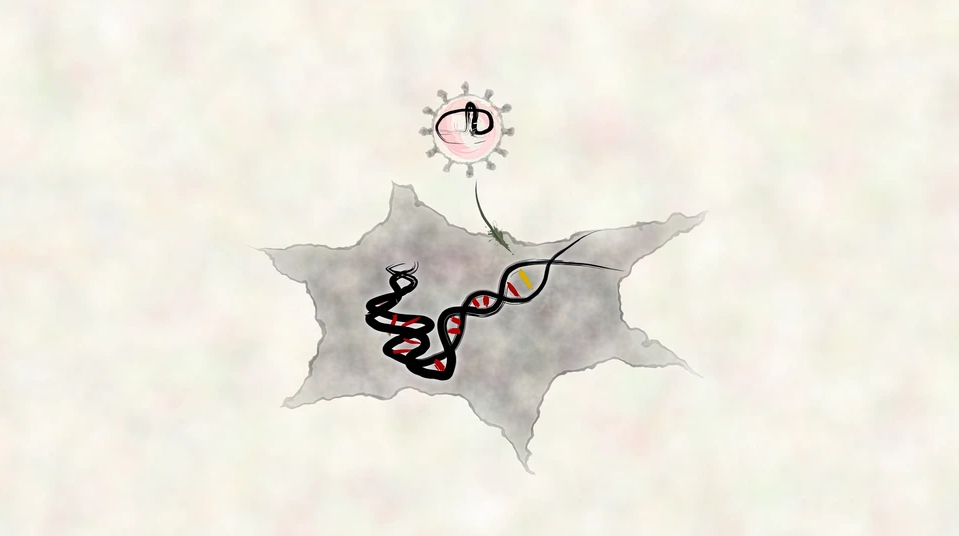
Das Forschungsteam um Dong-Jiunn Jeffery Truong und Gil Westmeyer vom Institut für Synthetische Biomedizin von Helmholtz Munich (ISBM) und der Technischen Universität München (TUM) hat ein modulares System von virusähnlichen Partikeln entwickelt, mit dem sich zwei Schwachpunkte herkömmlicher Transportsysteme überwinden lassen. Es stabilisiert die RNA-Komponente und sorgt für eine effiziente Verpackung von ausschließlich funktionsfähigen Gen-Editoren in den Zielzellen. Das im Fachmagazin Cell vorgestellte System soll die gezielte genetische Veränderung von Immunzellen für die Krebstherapie vereinfachen.
„Bisherige virale und nicht-virale Transportsysteme wie Adeno-assoziierte Viren, Lipid-Nanopartikel oder andere virusähnliche Partikel haben zwar wertvolle Dienste geleistet – stoßen aber an ihre Grenzen“, erläutert Truong. ENVLPE (Engineered Nucleocytosolic Vehicles for Loading of Programmable Editors) basiert auf modifizierten Hüllen viralen Ursprungs. Diese nicht-infektiösen virus-ähnlichen Partikel (VLPs) dienen als Trägersysteme für CRISPR-Werkzeuge wie Basen- oder Prime-Editoren. Damit die Cas9-Nukleasen mit ihren Komponenten aus sgRNA (single guide) oder pegRNA (prime editing guide RNA) sicher und effizient in die Zielzellen gelangen können, werden sie während der Produktion durch einen gezielt umgeleiteten zellulären Transportmechanismus zusammengeführt. Das System erlaubt das Shuttling von vorgeformten Editor-Komplexen mit ihren RNA-Komponente vom Kern ins Zytoplasma. Die Kopplung von Aptameren an die RNAs ermöglicht die effiziente Rekrutierung der Protein-bindenden RNA-Strukturen an die VLP-Hüllenproteine. Auf diese Weise wird gewährleistet, dass nur vollständig zusammengesetzte Editoren verpackt werden, wodurch die Erfolgsrate der Editierungstechniken erhöht wird. Gleichzeitig lassen sich die empfindlichen 3´-Endbereiche von pegRNAs durch hochaffine Bindung einer Csy4-Schutzkappe an entsprechende Aptamer-Sequenzen während des Transports vor Abbau schützen.
Die VLP-Trägersysteme haben den Vorteil, dass sie keine viralen Gene enthalten. Da sie außerdem nicht dauerhaft in Zellen verbleiben, verringert sich das Risiko von Immunreaktionen oder Nebenwirkungen. Das modulare System soll sich für verschiedene Zelltypen nutzen und zudem leicht an gängige Genomeditoren sowie zukünftige Entwicklungen anpassen lassen. Die Forscher arbeiten daran, die Zielgenauigkeit durch KI-gestütztes Protein-Design noch weiter zu erhöhen. „Das hochmodulare ENVLPE-System bringt uns der präzisen, maßgeschneiderten genetischen Veränderung komplexer Zellmodelle einen großen Schritt näher“, so Gil Westmeyer, Direktor des ISBM. „Sie zeigt, wie die Synthetische Biologie den Weg für medizinische Innovationen bereiten kann.“
Erste Anwendung fand das System bei der Behandlung von angeborener Blindheit in Mausmodellen. Nach der Injektion von ENVLPE in die Retina ließen sich die zugrundliegenden Mutationen in vivo erfolgreich korrigieren und die Sehfähigkeit konnte wiederhergestellt werden. Dafür war eine deutlich geringere Dosis als bei herkömmlichen Methoden notwendig. Auch für die Krebstherapie könnte das System neue Möglichkeiten eröffnen: In einer Kollaboration mit dem Klinikum der TUM gelang es den Forschern, gezielt MHC- und T-Zell-Rezeptoren von Immunzellen zu entfernen, damit sie beim Empfänger keine Immunreaktion auslösen. Durch eine adoptive T-Zell-Therapie könnten Immunzellen aus dem Blut von Patienten ex vivo nun auch genetisch so verändert werden, dass sie Tumorzellen gezielt erkennen und angreifen können.

 Leibniz-Institut für Pflanzengenetik und Kulturpflanzenforschung IPK Gatersleben, Andreas Baehring
Leibniz-Institut für Pflanzengenetik und Kulturpflanzenforschung IPK Gatersleben, Andreas Baehring Robert Hoffie
Robert Hoffie Screenshot Biocom interrelations GmbH
Screenshot Biocom interrelations GmbH