Rundum-Zulassung für Lucentis-Biosimilar
Nach Großbritannien und den USA hat auch die EMA "ja" gesagt. Ein deutsch-polnisches Gemeinschafts-Biosimilar zu Lucentis® (Ranibizumab-Injektion) hat für die Behandlung mehrerer schwerer Netzhauterkrankungen die Zulassung in der Europäischen Union erhalten.
Das Firmenkonsortium Polpharma Biologics Group BV, Formycon AG und Bioeq AG freut sich über die Marktzulassung der Europäischen Kommission für Ranivisio® (Ranivisio – Ranibizumab), ein Biosimilar zu Lucentis® (Ranibizumab-Injektion), für die Behandlung mehrerer schwerer Netzhauterkrankungen. Die EU-Zulassung folgt auf eine positive Stellungnahme des Ausschusses für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) vom Juni 2022 und gilt für alle 27 EU-Mitgliedstaaten der sowie Island, Norwegen und Liechtenstein.
FYB201/Ranivisio wurde von Bioeq, einem Joint Venture zwischen Polpharma Biologics und Formycon, entwickelt. Mitte 2021 schloss Teva Pharmaceutical Industries Ltd. eine strategische Partnerschaft für die exklusive Vermarktung von FYB201 in Europa und ausgewählten anderen Ländern. Die Markteinführung in ganz Europa ist für das kommende Jahr geplant, und in Großbritannien ist das Medikament bereits unter dem Markennamen Ongavia®ii3 erhältlich, nachdem es im Mai 2022 von der Medicines and Healthcare products Regulatory Agency (MHRA) zugelassen wurde.
Anfang August war die FDA den Briten gefolgt und hatte grünes Licht signalisiert. Für die exklusive Vermarktung von FYB201 in den USA unter dem Handelsnamen CIMERLI™ wurde mit Coherus BioSciences, Inc. Ende des Jahres 2019 eine Lizenzvereinbarung abgeschlossen. Der Vermarktungsstart für CIMERLI™, in den Darreichungsformen 0,3mg und 0,5 mg ist durch Coherus für Anfang Oktober 2022 in den USA vorgesehen.
Ranivisio ist indiziert für die Behandlung der neovaskulären (feuchten) altersbedingten Makuladegeneration (nAMD), die Behandlung von Sehbehinderungen aufgrund eines diabetischen Makulaödems (DME) oder einer choroidalen Neovaskularisation (CNV), die Behandlung der proliferativen diabetischen Retinopathie (PDR) sowie die Behandlung von Sehbehinderungen aufgrund eines Makulaödems infolge eines Netzhautvenenverschlusses (Ast-RVO oder Zentral-RVO).
Die Martinsrieder Formycon hat zwei weitere Biosimilar-Projekte bereits in der Phase III der klinischen Entwicklung. In einer Asset-Umstrukturierung unter den Anteilseignern (unter anderen die Gebrüder Strüngmann) und dem Abschluss der Transaktion mit der ATHOS KG hatte sich die Beteiligungsstruktur an diesen Biosimilar-Kandidaten verändert: Formycon verfügt nun über 100% der Rechte an FYB202 (zuvor 24,9%) sowie über 50% der Rechte (zuvor vollständige Auslizenzierung mit Royalty-Beteiligung) an FYB201 – dem eben zugelassenen Lucentis-Analogon. Das Beteiligungsmodell bei FYB203 ist eine Auslizenzierung an die Klinge Biopharma GmbH. Hier wird Formycon über entsprechende Royalties an den zukünftigen Produktumsätzen beteiligt sein.


 Charité/Maria Streltsova
Charité/Maria Streltsova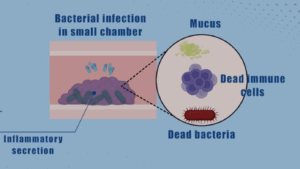 Haidong Yu
Haidong Yu