FDA-Zulassung für Gentherapie Casgevy
Das an der Nasdaq notierte Biotech-Unternehmen CRISPR Therapeutics (Zug, Schweiz) hat mit seinem Partner Vertex Pharmaceuticals nach der Zulassung im Vereinigten Königreich auch von der US-amerikanischen Gesundheitsbehörde FDA die Zulassung für die Gentherapie Casgevy erhalten.
Die CRISPR Therapeutics AG (Zug, Schweiz) und ihr Partner Vertex Pharmaceuticals erhielten nach der Zulassung im Vereinigten Königreich nun auch von der US-amerikanischen Gesundheitsbehörde FDA die Zulassung für die Gentherapie Casgevy. Damit „sei erstmals eine Gentherapie zur Behandlung von Patienten mit Sichelzellanämie zugelassen worden“, teilte die FDA am Freitagabend in einer Aussendung mit. Die Zulassung von Mitte November in Großbritannien blieb unerwähnt. Die FDA-Zulassung gilt für Patienten ab 12 Jahren.
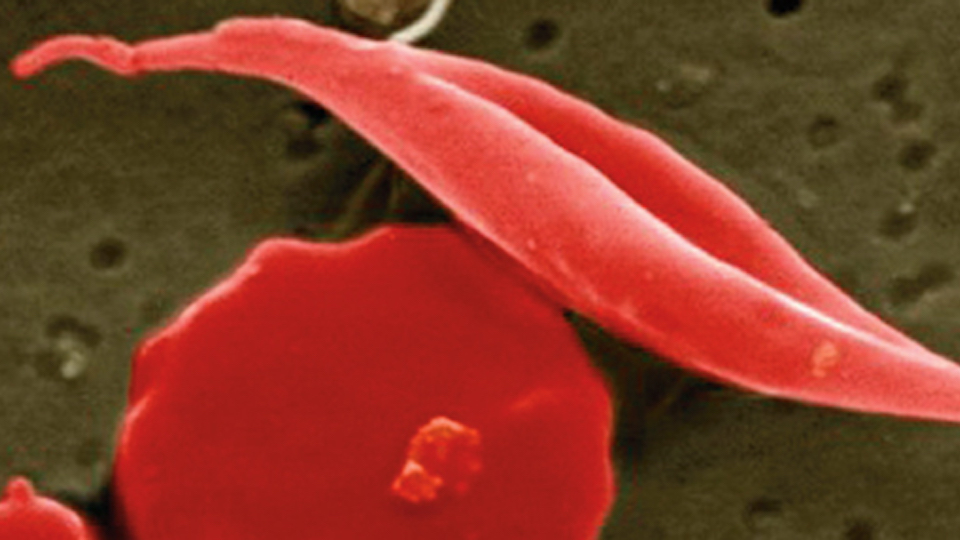
Die Sichelzellanämie ist eine erbliche Blutkrankheit, bei der defekte rote Blutkörperchen zu wenig Sauerstoff transportieren und die Adern verstopfen können. Dadurch werden Gewebe und Organe geschädigt, was zum Tod führen kann. In den USA leiden laut FDA rund 100.000 Menschen an der Krankheit. Die Sichelzellanämie hat die größte Verbreitung in den Malariagebieten Afrikas und Asiens. In Äquatorialafrika sind 25 bis 40 % der Bevölkerung heterozygote Merkmalsträger, da diese veränderten roten Blutkörperchen ihrerseits gegen die Infektion mit Malaria schützen und einen gewissen Überlebensvorteil an dieser Stelle bieten.
Die Therapie Casgevy nutzt die CRISPR/Cas9-Technologie, mit der die DNA von blutbildenden Knochenmarkzellen geschnitten und das fehlerhafte DNA-Stücke entfernt werden kann. Die veränderten blutbildenden Knochenmarkzellen werden dem Patienten anschließend wieder implantiert. Dadurch werde die Produktion gesunder roter Blutkörperchen angeregt, so die FDA.
Diese Stammzelltransplantation ist teuer: Laut der Nachrichtenagentur Reuters kostet eine einmalige Behandlung mit Casgevy 2,2 Mio. US-Dollar. Als Folge der FDA-Zulassung erhält CRISPR Therapeutics nun von Vertex eine Meilensteinzahlung von 200 Mio. US-Dollar. Weitere Gewinne aus der Vermarktung der Therapie teilen sich die beiden Unternehmen 40:60 (CRISPR/Vertex). Allerdings lässt der hohe Preis keinen fulminante Marktdurchdringung gerade in den stark betroffenen Weltregionen erwarten.
Am gleichen Tag hat die FDA auch eine andere Therapie gegen die Sichelzellenanämie zugelassen: die Gentherapie Lyfgenia von bluebird bio. Die Zulassung erfolgte zwei Wochen früher als geplant. Anleger reagierten jedoch negativ auf die Preispläne von bluebird bio für seine neue Sichelzelltherapie: Die in Boston ansässige Firma, die bereits zwei andere Gentherapien vertreibt, musste einen Kursrückgang von 40% hinnehmen, nachdem sie bekannt gegeben hatte, dass der Preis für Lyfgenia bei 3,1 Mio. US-Dollar liegen würde, 900.000 US-Dollar mehr als für Casgevy von Vertex und CRISPR.

 Freepik.com
Freepik.com Robert Hoffie
Robert Hoffie Elnur Amikishiyev-stock.adobe.com
Elnur Amikishiyev-stock.adobe.com