
ITM: Details zu Daten der Radioligandentherapie
Ende Januar waren es nur Hinweise aus den sogenannten Top-Line-Ergebnissen der Phase III-Studie der Münchner Isotopenwirkstoffentwickler ITM SE. Nun wurden anlässlich einer Konferenz in Krakau, Polen, Details veröffentlicht. Sie deuten bei der ITM-Radiotherapie gegenüber der Standardbehandlung auf eine deutliche Verbesserung der progressionsfreien Überlebenszeit hin und erreichen den primären Endpunkt der Studie. Ein Fragezeichen bleibt beim sekundären Endpunkt des Gesamtüberlebens in beiden Untersuchungsarmen nach der langen Zeitspanne von fast fünf Jahren: dort sind die Unterschiede kaum merklich, was aber daran liegen könnte, dass die Krebspatienten unter Standardbehandlung die Möglichkeit erhielten, sich ebenfalls eine wirksamere Therapie zu suchen.
Die ITM SE präsentiert auf der 22. Jahrestagung der European Neuroendocrine Tumor Society in Krakau, Polen, Details zu den Topline-Phase-III-Daten der COMPETE-Studie mit n.c.a. 177Lu-edotreotid (ITM-11), einer zielgerichteten radiopharmazeutischen Therapie, bei Patienten mit Grad-1- oder Grad-2-gastroenteropankreatischen neuroendokrinen Tumoren. Die Studie erreicht nach Unternehmensdarstellung den primären Endpunkt und zeigt eine klinisch sowie statistisch signifikante Verbesserung des progressionsfreien Überlebens (PFS) im Vergleich zur Standardbehandlung mit dem Immunsuppressor Everolimus.
ITM plane mit diesen Daten im laufenden Jahr die Einreichung eines Zulassungsantrags (NDA) in den USA. Die COMPETE-Studie schloss Patienten ein mit Grad-1- oder Grad-2-somatostatinrezeptor-(SSTR)-positiven gastroenteropankreatischen neuroendokrinen Tumoren (GEP-NETs). „COMPETE ist die erste richtungsweisende Studie, die ein radiopharmazeutisches Medikament direkt mit einer zielgerichteten molekularen Therapie vergleicht, ohne dass begleitend Somatostatin-Analoga routinemäßig eingesetzt wurden“, sagte Dr. Capdevila, leitender Onkologe am Vall d’Hebron University Hospital in Barcelona. „Diese Daten liefern eindeutige Belege für das Potential von 177Lu-edotreotid zur Verlängerung des PFS. Zudem unterstreichen der bequeme Dosierungsplan sowie das günstige Sicherheitsprofil von 177Lu-edotreotid dessen Potential als vielversprechende neue Behandlungsoption.“
COMPETE ist eine prospektive, randomisierte, kontrollierte, offene Phase III-Studie mit 309 Patienten mit inoperablen, fortschreitenden Grad-1- oder Grad-2-SSTR-positiven neuroendokrinen Tumoren gastroenterischen oder pankreatischen Ursprungs (Ki-67 ≤20%) aus Europa, den USA, Australien und Südafrika. Die Studie untersuchte die Wirksamkeit und Sicherheit von 177Lu-edotreotid im Vergleich zu Everolimus. 177Lu-edotreotid besteht aus nicht-trägerangereichertem (n.c.a.) Lutetium-177, einem therapeutischen beta-Strahler, sowie Edotreotid, einem Somatostatin-Rezeptor-Agonisten. Es ist das erste Radiopharmazeutikum, das in der GEP-NET-Patientenpopulation mit nicht-trägerangereichertem Lutetium getestet wurde, welches eine höhere isotopische Reinheit aufweist als trägerangereichertes Lutetium.
Die Patienten wurden im Verhältnis 2:1 randomisiert. „Die COMPETE-Ergebnisse stellen einen bedeutenden Fortschritt in der Entwicklung neuer Behandlungsoptionen für Patienten mit fortschreitenden, inoperablen GEP-NETs dar. Durch die Verlängerung des progressionsfreien Überlebens um fast zehn Monate im Vergleich zur Standardtherapie zeigt 177Lu-edotreotid das Potential, das Behandlungsparadigma für Ärzte und Patienten signifikant zu verbessern“, erklärte Dr. Jonathan Strosberg, ehemaliger Präsident der North American Neuroendocrine Tumor Society und Leiter des GI-Forschungsprogramms am Moffitt Cancer Center and Research Institute in Tampa, Florida.
Auf den zweiten Blick fallen die Daten des sekundären Endpunktes ins Auge: das mediane Gesamtüberleben. Nach beinahe fünf Jahren Behandlungs- und Beobachtungszeitraum war der Unterschied der beiden Studienteilnehmergruppen zum 21. Januar 2025 nicht gravierend unterschiedlich:
- 63,4 Monate in der 177Lu-edotreotid-Gruppe
- 58,7 Monate in der Everolimus-Gruppe
Da Patienten nach Krankheitsprogression auf eine alternative Therapie umgestellt werden durften, könnte dies die Gesamtüberlebensdaten beeinflusst haben, so die Interpretation durch ITM zum derzeitigen Augenblick. Auch auf |transkript.de-Nachfrage, war der Unternehmensleitung hierzu keine weitere Erklärung abzuringen. Die Gesamtüberlebensdaten werden auch weiterhin aktualisiert. Obwohl nicht statistisch signifikant, zeige die Zwischenanalyse einen positiven Trend zugunsten von 177Lu-edotreotid.
Bei ITM wird nun dem guten Abschneiden beim primären Endpunkt die größere Bedeutung beigemessen. „Diese erfolgreichen Ergebnisse bestätigen unsere Entscheidung, eine zentrale Phase III-Studie zu konzipieren, die ein zielgerichtetes Radiopharmazeutikum direkt mit einer zielgerichteten molekularen Therapie bei Grad-1/2-GEP-NETs vergleicht. Dies unterstreicht unser Engagement, die Lebensqualität von Menschen mit dieser herausfordernden Krebserkrankung zu verbessern“, so Dr. Andrew Cavey, CEO von ITM. „Mit diesem erfolgreichen Studienergebnis wird 177Lu-edotreotid das erste Medikament in ITMs umfangreichem Portfolio von Radiopharmazeutika in frühen bis späten Entwicklungsstadien, das positive Phase-3-Daten liefert und sich auf eine NDA-Einreichung sowie die kommerzielle Markteinführung vorbereitet.“
ITM sieht sich mit seinem globalen Isotopenproduktionsgeschäft, einer robusten Lieferkette sowie dem erfahrenen klinischen und kommerziellen Team bestens aufgestellt, als führendes Unternehmen in der schnell wachsenden Radiopharmaindustrie eine „einzigartige Position“ zu erreichen.

 Pentixapharm Holding AG
Pentixapharm Holding AG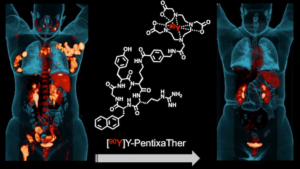 by the Society of Nuclear Medicine (Buck AK, Grigoleit GU, Kraus SK, Schirbel A, Heinsch M, Dreher N, Higuchi T, Lapa C, Hänscheid H, Samnick S, Einsele H, Serfling SE, Werner RA. C-X-C Motif Chemokine Receptor 4-Targeted Radioligand Therapy in Patients with Advanced T-Cell Lymphoma. J Nucl Med. 2022), Uniklinikum Würzburg
by the Society of Nuclear Medicine (Buck AK, Grigoleit GU, Kraus SK, Schirbel A, Heinsch M, Dreher N, Higuchi T, Lapa C, Hänscheid H, Samnick S, Einsele H, Serfling SE, Werner RA. C-X-C Motif Chemokine Receptor 4-Targeted Radioligand Therapy in Patients with Advanced T-Cell Lymphoma. J Nucl Med. 2022), Uniklinikum Würzburg