Zellrezeptoren in Aktion beobachten
Dank eines innovativen NMR-Ansatzes gelang es einem Schweizer Forschungsteam, die dynamischen Konformationsänderungen eines G-Protein-gekoppelten Rezeptors im Detail nachzuvollziehen und so völlig neue Einblicke in seine Funktionsweise zu gewinnen.
Etwa ein Drittel aller zugelassenen Medikamente richtet sich gegen membranständige G-Protein-gekoppelte Rezeptoren (GPCR) – von Diabetesmitteln wie Semaglutid über Opioide und Psychopharmaka bis hin zu Betablockern. Die Wirkung dieser Blutdrucksenker auf den β1-Adrenozeptor konnte das Team um Prof. Dr. Stephan Grzesiek vom Biozentrum der Universität Basel nun entschlüsseln. Die kürzlich in Science veröffentlichten Ergebnisse zeigen detailliert, wie sich der Rezeptor bewegt – im Wechsel zwischen verschiedenen Aktivierungszuständen. Die Arbeit schließt eine jahrzehntelange Lücke in der Strukturbiologie – und liefert damit der Arzneimittelforschung ein mächtiges neues Werkzeug. Ein genaues Verständnis der Rezeptorfunktionsweise ermöglicht die Entwicklung wirksamerer Medikamente mit weniger Nebenwirkungen.
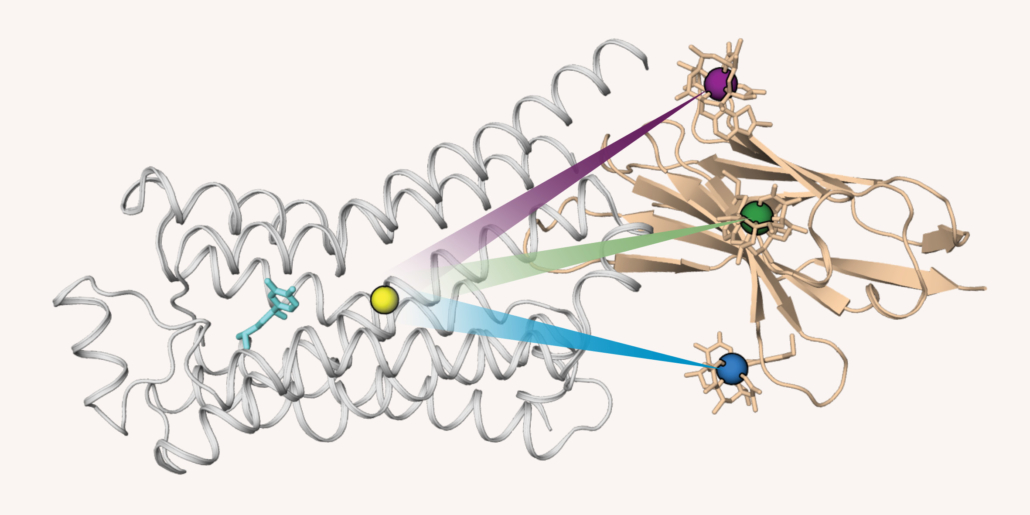
„Nach zwanzig Jahren Forschung können wir nun endlich die atomaren Bewegungen des Rezeptors sehen“, so Grzesiek erfreut. Gelungen ist dies dank der innovativen GPS-PCS-Technologie, die bei der Kernspinresonanzspektroskopie (NMR) entstehende paramagnetische chemische Verschiebungen (PCS) nutzt, um den Bewegungen des Rezeptors wie ein GPS folgen zu können. Dafür wurde die Position von 162 einzelnen markierten 1H und 15N-Atomkernen innerhalb des Adrenozeptors exakt lokalisiert. Ermöglicht wurde das durch Bindung eines Nanobodys mit winzigen Magneten anstelle des G-Proteins.
In der aktuellen Studie ließ sich auf diese Weise nach Bindung der Agonisten (Isoprenalin) oder Antagonisten (Carvedilol) an den Rezeptor dessen Konformationsänderung in atomarer Auflösung nachvollziehen. Überraschend verhält sich der Adrenozeptor nicht wie ein einfacher Schalter mit nur zwei Zuständen – an oder aus. Vielmehr pendelt er in einem dynamischen Gleichgewicht zwischen inaktiver, teilaktiver und vollaktiver Konformation. Bei Bindung von Isoprenalin verschiebt sich das Gleichgewicht stark in Richtung aktivem Zustand, während Betablocker wie Carvedilol den Rezeptor in der inaktiven Form fixieren. So konnten die Basler Forscher erstmals den dynamischen Wechsel zwischen den Zuständen beobachten. Darüber hinaus identifizierten sie den molekularen Schalter, der diese Übergänge steuert: Ein zentrales und hochkonserviertes Proteinmotiv (xWIPF3) überträgt die Bewegung der Proteinregionen von der Liganden-Bindungsstelle ins Zellinnere.
Bisher waren nur statische Momentaufnahmen von GPCR-Strukturen oder physikalische Messungen mit zu geringer Auflösung möglich. Dank der hochaufgelösten GPS-PCS-Technologie lässt sich nun genau verstehen, wie die Bindung eines Wirkstoffs die Rezeptor-Funktion steuert. Dieses Wissen soll dabei helfen, Medikamente zu entwickeln, die den Schaltmechanismus gezielt beeinflussen können.

![Online-Seminare-28012025[61] Online-Seminare-28012025[61]](https://transkript.de/wp-content/uploads/2024/12/Online-Seminare-2801202561-300x169.jpg)