Hoher Millionenverlust bei Crispr Therapeutics
Das an der Nasdaq notierte Biotech-Unternehmen Crispr Therapeutics mit Sitz in Zug (Schweiz) hat das Geschäftsjahr 2022 mit tiefroten Zahlen abgeschlossen. Der Verlust beläuft sich laut Geschäftsbericht auf 650,2 Mio. US-Dollars.
Das hatte schon einmal anders ausgesehen: 2021 hatte noch ein Gewinn von 378 Mio. in den Büchern gestanden, der aus einem Sondereffekt und damaligen Umsatzerlösen von 915 Mio. US-Dollar resultierte. Damals hatte Crispr von einer hohen Upfront-Zahlung des Kooperationspartners Vertex profitiert. In einem normalen Geschäftsjahr ist das forschende Unternehmen jedoch eher mit einem einstelligen Millionenumsatz unterwegs (2022: 1,2 Mio. US-Dollar). Der Verlust stammt aus den sehr hohen Kosten für F&E: Die Forschungsausgaben legten im vergangenen Jahr auf 461,6 Mio. US-Dollar von zuvor schon 340,6 Millionen nochmals zu, während die weiteren Kosten bei Personal und Verwaltung sich in etwa auf dem Vorjahresniveau stabilisierten.
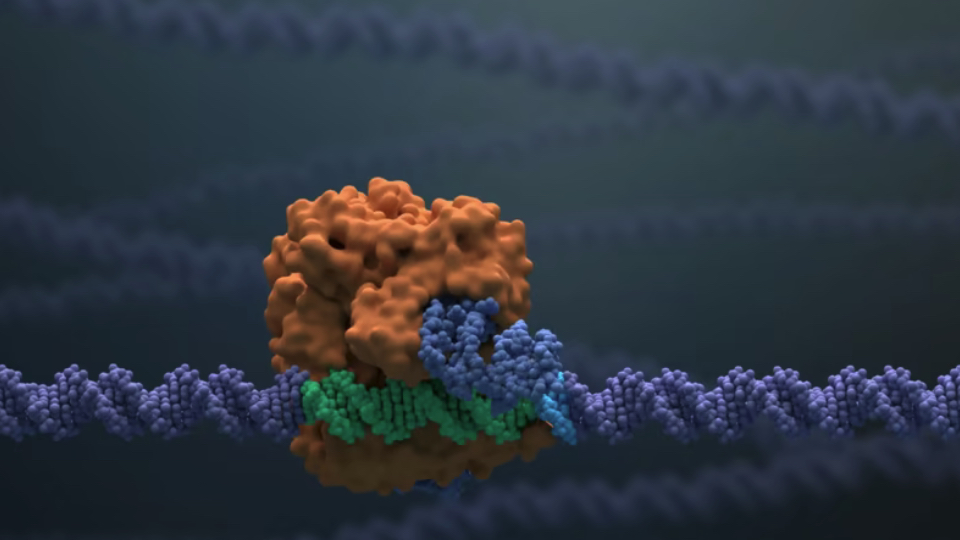
Crispr Therapeutics ist das von Nobelpreisträgerin Emmanuelle Charpentier mitgegründete Unternehmen, in der die CRISPR/Cas9-Gen-Editierungstechnologie in "transformative Medikamente für schwere menschliche Krankheiten" umgesetzt werden soll. Es wurde 2013 von den Baseler Büros von Versant Ventures aus gegründet und unter anderem mit etlichen Millionen der Bill und Melinda Gates-Stiftung ausgestattet (die jedoch auch hohe Summen in Konkurrent Editas gesteckt hat). Derzeit hat Crisp einige verpartnerte Programme in der Klinik.
Exa-cel (exagamglogene autotemcel) ist eine in der Erprobung befindliche autologe, ex vivo CRISPR/Cas9-geneditierte Therapie für Patienten, die an den schweren monogenetischen Krankheiten transfusionsabhängige β-Thalassämie (TDT) und Sichelzellkrankheit (SCD) leiden. Hier sollen die eigenen hämatopoetischen Stammzellen des Patienten so editiert werden, dass sie hohe Mengen an fetalem Hämoglobin (HbF; Hämoglobin F) in den roten Blutkörperchen produzieren. HbF ist die Form des sauerstofftransportierenden Hämoglobins, die während der fötalen Entwicklung vorhanden ist und nach der Geburt in die erwachsene Form des Hämoglobins übergeht. Die Anhebung von HbF durch Exa-cel hat das Potential, den Transfusionsbedarf von Patienten mit TDT zu verringern und schmerzhafte sowie schwächende Sichelkrisen bei Patienten mit SCD zu reduzieren. Exa-cel wurde von der FDA in diverse beschleunigte Zulassungsverfahren aufgenommen, wie Regenerative Medicine Advanced Therapy (RMAT), Fast Track, Orphan Drug und Rare Pediatric Disease. Auch die Europäische Kommission hat Exa-cel für TDT und SCD den Orphan-Drug-Status zuerkannt, die Europäische Arzneimittelagentur (EMA) den PRIME-Status (Priority Medicines).
Neben diesem Ex-vivo-Verfahren einer Geneditierung von Patientenzellen in den beiden Indikationen arbeitet Crispr auch an In-vivo-Verfahren, bei denen alle Werkzeuge der Genommodifizierung in Lipidpartikeln im Patienten selbst ihr Werk verrichten sollen. Diese Arbeiten sind jedoch noch nicht in der klinischen Entwicklung angekommen. Es steht noch viel kostenträchtige Arbeit an in Boston und Zug, um die nobelpreisgewürdigte Methode in echte Therapieinnovationen umzusetzen.


 Illustration NIH.gov
Illustration NIH.gov Ostdeutsches Wirtschaftsforum
Ostdeutsches Wirtschaftsforum Qiagen N.V.
Qiagen N.V.