
Verbände kritisieren EU-Pharmapaket
Biopharma-Industrieverbände haben das am Freitag vom Europaparlament angenommene EU-Pharmapaket als zu unambitioniert kritisiert.
Am Freitag hatte das Europaparlament der umfassendsten Änderung des EU-Arzeimittelrechtes seit 20 Jahren mit einigen Änderungswünschen zugestimmt. Die Industrieverbände EuropaBio, BPI und vfa zeigten sich insgesamt unzufrieden mit dem Ergebnis: „Für den Pharmastandort wurde eine Chance vertan”, meinte vfa-Präsident Han Steutel. „Weder wurde Europas Profil als Innovationszentrum geschärft, noch wird die Versorgung der Patienten verbessert. Insbesondere die geplante Schwächung des Unterlagenschutzes ist innovationsfeindlich.“
In der Kritik der Pharmaverbände BPI und vfa steht vor allem um die Dauer des Unterlagenschutzes, der bisher acht Jahre nach Marktzulassung betrug. Beim Unterlagenschutz geht es darum, den Herstellern einer kostspieligen Arzneimittelinnovation Schutz vor Fremdnutzung der eigenen Studiendaten in Zulassungsanträgen zu gewähren. Solange er gilt, darf ein Unternehmen, das die Zulassung für ein Generikum oder Biosimilar des betreffenden Originalmedikaments beantragt, nicht auf die Unterlagen des Originalherstellers mit dessen Ergebnissen der präklinischen und klinischen Untersuchungen zum Nachweis der Sicherheit und Wirksamkeit des Nachahmerproduktes zurückgreifen.
Zwar stimmten die EU-Parlamentarier für eine Verlängerung der für die Vermarkter wichtigen Schutzrechte von 6 auf 7,5 Jahre – doch das ist den Unternehmen, die auf den bisherigen 8 Jahren Datenschutz beharren, zu wenig, um den Standort Europa voranzubringen. Auch die Verlängerung des Unterlagenschutzes um ein Jahr bei vergleichenden Studien mit First-in-class-Arzneikandidaten auf 8,5 Jahre erachten die Verbände als zu kurz, um einen angemessenen return on investment beziehungsweise Schutz vor günstigeren Biosimilars und Nachahmerpräparaten zu erzielen.
Erst recht kritisieren die Pharmaverbände und der EU-Biotech-Verband EuropaBio die Signalwirkung, die mit der geplanten Absenkung der Marktexklusivität von Orphan Drugs von derzeit zehn auf neun Jahre einhergeht. „Der Entwurf in seiner jetzigen Form wird nicht ausreichen, um Europas Führungsanspruch in der Biotechnologie hinreichend zu unterstützen”, verlautete die europäische Biotech-Interessenvertretung EuropaBIO. Der Europarat müsse jetzt intervenieren, um den Wert europäischer Biotech-Innovationen zu schützen und sicherzustellen, dass die europäischen Patienten rechtzeitig Zugang zu Arzneimitteln mit hohem therapeutischen Wert erhalten, so der Verband.
„Leider schafft es das EU-Pharmapaket immer noch nicht, die pharmazeutische Industrie in Europa im globalen Wettbewerb zu stärken und den Standort insgesamt attraktiver zu gestalten“, erklärte auch Dr. Kai Joachimsen, Hauptgeschäftsführer des Bundesverbandes der Pharmazeutischen Industrie e.V. (BPI) anlässlich der Abstimmung im EU-Parlament. Es gebe noch viel Raum für Verbesserungen, insbesondere bei den EU-Mitgliedstaaten. „Deutschland hat bereits mit seiner Nationalen Pharmastrategie einen ersten guten Vorstoß geleistet“, so Joachimsen. Die guten Ansätze müssen nun auch auf europäischer Ebene durchdringen.

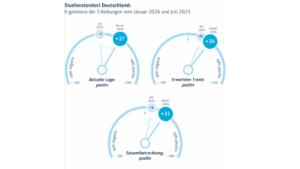 BVMA, vfa, BPI
BVMA, vfa, BPI sudok1 - stock.adobe.com
sudok1 - stock.adobe.com areporter - stock.adobe.com
areporter - stock.adobe.com