Neues Verfahren eröffnet Produktion von Tregs
Wissenschaftler um den Medizinnobelpreisträger Shimon Sakaguchi haben ein Verfahren vorgestellt, das entzündungsfördernde Immunzellen quantitativ in antigenspezifisch entzündungshemmende regulatorische T-Zellen verwandelt. Funktioniert das im Tier erprobte Verfahren zur Treg-Induktion auch im Menschen, wäre es ein Ansatz, Autoimmunkrankheiten und Transplantatabstoßung ohne Immunsuppressiva gezielt zu behandeln.
Stammzellforscher um den diesjährigen Medizinnobelpreisträger Shimon Sakaguchi präsentieren in zwei aktuellen Publikationen vielversprechende präklinische Daten zu einem neuen immunmodulatorischen Verfahren. Damit gelang es erstmals, antigenspezifische Entzündungsreaktionen zu stoppen, ohne auf eine systemische Immunsuppression angewiesen zu sein. In Tiermodellen zu drei verschiedenen Autoimmunerkrankungen wurde die überschießende Immunreaktion gezielt unterbunden.
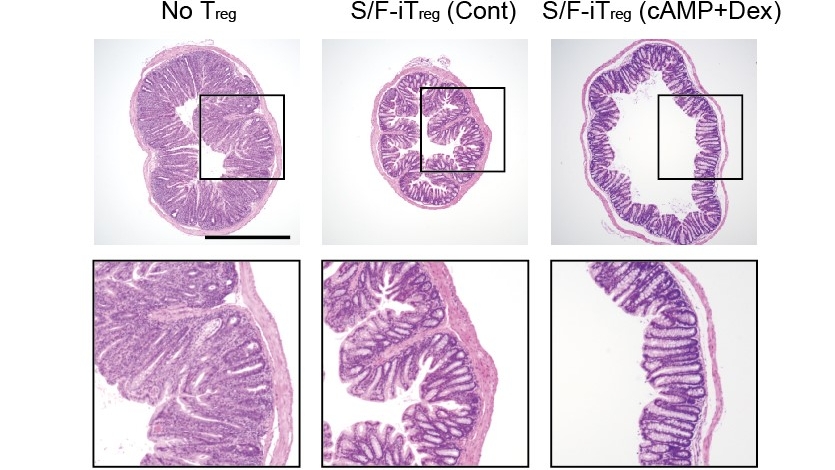
Norihisa Mikami und Kollegen setzten die Methode erfolgreich ein, um chronische Darmentzündungen sowie die gefürchtete Graft-versus-Host-Reaktion nach Transplantationen zu unterdrücken. Miho Mukai und Kollegen behandelten zudem Mäuse mit der Autoimmunerkrankung Pemphigus vulgaris, die schmerzhafte Hautblasen verursacht. Durch die Infusion umprogrammierter T-Zellen erzielten sie eine deutliche klinische Verbesserung.
Regulatorische T-Zellen als Schlüssel zur Therapie von Autoimmunerkrankungen
Normalerweise kontrolliert der Körper Entzündungen über ein fein abgestimmtes Gleichgewicht des Immunsystems. Eine zentrale Rolle spielen dabei regulatorische T-Zellen (Tregs), die überschießende Immunreaktionen bremsen. Bei Autoimmunerkrankungen ist dieser Schutzmechanismus jedoch gestört. Daher zielen neue Therapieansätze darauf ab, den Treg-Pool wiederherzustellen. Bisher fehlten jedoch zuverlässige Methoden zur Herstellung antigenspezifischer Tregs in ausreichender Menge – weshalb bestehende Behandlungen häufig das gesamte Immunsystem schwächen.
Durchbruch: stabile FoxP3-positive Tregs aus entzündungsvermittelnden T-Zellen
In den Ende Oktober in Science Translational Medicine veröffentlichten Studien gelang es erstmals, entzündungsfördernde Tconv-Zellen dauerhaft in FoxP3-positive Tregs umzuprogrammieren, die eine stabile, antigenspezifische Immunsuppression zeigten – vergleichbar mit natürlich vorkommenden Tregs (nTregs).
Die Umwandlung erfolgte in vitro bei Maus und Mensch, indem CDK8/19 gehemmt wurde. Dies induzierte eine starke FoxP3-Expression in antigen- und IL-2-stimulierten Tconv-Zellen. Gleichzeitig erzeugten Mikami und Kollegen typische epigenetische Treg-Signaturen, indem sie während der Induktion konsequent auf eine CD28-Kostimulation verzichteten. So konnten zentrale Treg-Signaturgene – insbesondere FoxP3 – stabil etabliert werden.
Durch wiederholte Zyklen mit Ruhephasen in reinen IL-2-Kulturen gelang die effiziente Umwandlung sowohl naiver T-Zellen als auch Effektor- und Gedächtnis-Tconv-Zellen (TH1, TH2, TH17).
Funktionelle Stabilität und Wirksamkeit in vivo
Die resultierenden induzierten Tregs (iTregs) ähnelten natürlichen Tregs sowohl im Transkriptionsprofil als auch in epigenetischen Modifikationen. In vivo zeigten sie sich phänotypisch stabil und unterdrückten erfolgreich:
-
chronisch-entzündliche Darmerkrankungen und
-
Graft-versus-Host-Reaktionen
Die Autoren betonen, dass nun geprüft werden muss, ob eine adoptive Treg-Zelltherapie beim Menschen als antigenspezifische, krankheitsspezifische Behandlung immunologischer Erkrankungen eingesetzt werden kann. Nächste Schritte sind Studien in Großtiermodellen und anschließend klinische Studien.

 Boehringer Ingelheim
Boehringer Ingelheim TECregen AG
TECregen AG Stadt Regensburg, Peter Ferstl
Stadt Regensburg, Peter Ferstl