Jülich: Krebs mit selektiver RNA ausschalten
Jülicher Forschern ist es gelungen, mit einer neuartigen RNA-Technologie gezielt die Tumorzellen eines Glioblastoms auszuschalten. Die "selektiv exprimierte" seRNA bildet nur in den Tumorzellen ein Protein, das diese Zelle in den Zelltod (Apoptose) treibt. Die Plattformtechnologie dahinter und diese ersten Ergebnisse aus dem Tierversuch bieten die Möglichkeit, den Ansatz auf eine Vielzahl von Krebsformen anzupassen und damit bald klinische Versuche zu starten. Das Start-up SRTD biotech hat die grundlegende Idee zur seRNA beigetragen und sich mit Beteiligung des HTGF die Expertise gesichert.
Viele Mäuse wurden im entsprechenden Tierversuch von dem bei ihnen induzierten Krebs „geheilt“. So viele, dass einerseits die entsprechenden Tierversuche in die Diskussion geraten sind, weil die Übertragbarkeit auf den Menschen häufig nicht so gut funktionierte. Beispielsweise stellt sich die Wechselwirkung von Zielmolekül und Wirkstoff beim Menschen anders dar als bei der Maus. Andererseits kranken viele der moderneren Behandlungsmethoden unter Nutzung des menschlichen Immunsystems daran, dass die Maus auch hier andere Gegebenheiten aufweist. Selbst die aufwendige Rekonstruktion eines menschlichen Immunsystems oder von Teilen davon weist in dem Versuchstier wiederum zahlreiche Einschränkungen auf, die die Übertragbarkeit von gewonnenen Daten auf die Situation einer klinischen Entwicklung schwierig und oft genug unmöglich machte.
Mit diesen einschränkenden Vorbemerkungen kann man sich dennoch hoffnungsvoll den aktuellen Ergebnissen aus dem Forschungszentrum Jülich unter PD Dr. Bernd Hoffmann und seinen Kollegen zuwenden. Hier steht im Vordergrund nicht die molekulare Vergleichbarkeit oder diejenige von bestimmten Zelltypen von Maus und Mensch, sondern, ob die ausgetüftelte RNA-Technologie überhaupt wie gewünscht funktioniert. Um es vorwegzunehmen: sie tut es (Publikation in Nature am 6. Januar, siehe unten).
Die Jülicher Wissenschaftler haben dazu im Verbund mit der SRTD biotech ein RNA-Molekül entwickelt, angelehnt an eine natürliche mRNA, das nur in erkrankten Zellen aktiv wird und dort zur Produktion von Wirkstoffen führt, die nur die „infizierte“ Zelle abtötet. Die neue RNA-Form wurde im Anschluss in enger Zusammenarbeit mit Partnern aus Köln, Würzburg und Straßburg im Detail charakterisiert.
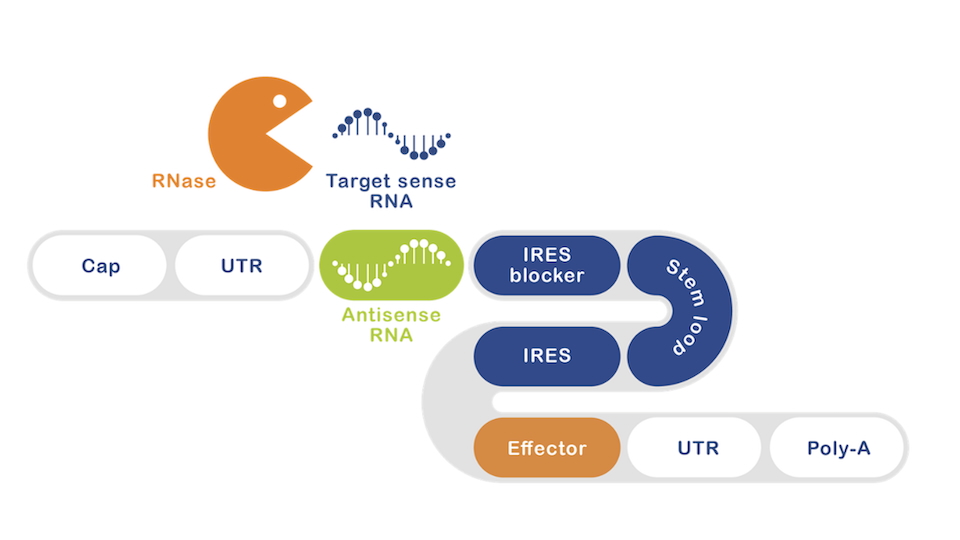
Die Forscher haben das Prinzip der mRNA als Ablesecode für ein zu produzierendes Protein nun zu einer selektiv exprimierten RNA (seRNA) weiterentwickelt. In einer Art Baukastenprinzip hat das Team um Hoffmann ganz unterschiedliche funktionale Einheiten auf einem mRNA-Strang aufgefädelt, der sich damit aus mehreren Bausteinen zusammensetzt. Ein wichtiger Baustein ist dabei eine Art hochspezifischer Sensor: Er erkennt in der Zelle, ob es sich um die erkrankte Zelle, zum Beispiel eine Glioblastomzelle handelt und liefert für eine tumorspezifische RNA die Sequenz einer Antisense-RNA, die sich zu einem RNA-Doppelstrang verbinden. Dieser RNA-Doppelstrang wird von der Zelle als möglicher Viren-Angriff bewertet und als Gefahr eingestuft, die einen Abbaumechanismus in Gang setzt, der auch einen Teil der seRNA betrifft.
Doch all dies ist gewollt. Die Antisense-RNA erfüllt keinen anderen Zweck als die hohe Zellspezifität des ganzen Konstruktes zu gewährleisten. Nur wenn die Zelle das Gegenstück, den spezifischen Tumormarker auch wirklich herstellt, der in gesunden Zellen nicht vorkommt, finden sich der Sense- und der Antisense-Partner. Durch den Teilabbau der eingeführten „Lego“-mRNA wird nun ein bisher in der 3D-Struktur des mRNA-Stranges verborgener Aktivator zugänglich, der seinerseits jetzt erst zur Produktion eines Enzyms führt, das die Krebszelle veranlasst, sich selbst zu zerstören. Je nach Wahl der seRNA-Bausteine kann individuell festgelegt werden, in welcher Zielzelle des Körpers die Aktivierung der seRNA erfolgt, und welches medizinisch wirksame Molekül produziert wird. In gesunden Zellen passiert hingegen aufgrund des Fehlens des Krebsmarkers nichts. Der Angriff gesunder Zellen und damit eventuelle Nebenwirkungen bei einer klinischen Behandlung können so vermieden werden.
Schaltbare RNA
„Die zelleigene RNA als ‚Schalter‘ zu nutzen, ist völlig neuartig“, erklärt Bernd Hoffmann vom Institut für Biologische Informationsprozesse, Bereich Mechanobiology (IBI-2) des Forschungszentrums Jülich und gleichzeitig Geschäftsführer der SRTD biotech. „Und das Baukasten-Prinzip macht die seRNA zu einer vielversprechenden Plattformtechnologie.“ Je nachdem, an welche mRNA-Bausteine die seRNA bindet und welche Proteinproduktion sie damit aktiviert, könne die neue Methode bei verschiedenen Krebserkrankungen eingesetzt werden, bei viralen Erkrankungen wie Hepatitis B, aber auch bei Autoimmunerkrankungen. „Mit der Entwicklung der seRNA-Moleküle für medizinische Anwendungen können wir den zielgerichteten Angriff erkrankter Zellen sicherstellen und dies gleichzeitig mit der selektiven Produktion von Wirkstoffen kombinieren“, sagt Prof. Dr. Rudolf Merkel, Direktor des IBI-2. Im Tierversuch des Glioblastoms war beispielsweise eine Caspase als Wirk-Protein in den mRNA-Strang integriert. Diese löst zellintern ein Apoptosesignal aus, was zum Selbstmord der „infizierten“ Zelle führt. Durch einen weiteren Fluoreszenzmarker markiert kann dieser Vorgang am Mikroskop überwacht werden.
Das Forschungszentrum Jülich hat der Patentierung der bahnbrechenden Erfindung durch Bernd Hoffmann keine Steine in den Weg gelegt. Dieser hat sich mit Hilfe einiger Business Angels finanziell so ausgestattet, dass die weltweiten Patente bereits in den USA, Europa und China gesichert werden konnten. Im Herbst 2024 stieß auch der Hightech-Gründerfonds (HTGF) zum Start-up SRTD biotech dazu, nun werden für weitere präklinische Tests und den schnellstmöglichen Weg in eine frühe klinische Validierung der vielversprechenden Technologieplattform weitere Geldgeber gesucht. Die Gespräche seien bereits weit fortgeschritten, sagte Hoffmann im Gespräch mit |transkript.de.
Das IBI-2 des Jülicher Forschungszentrums wird die Technologie der schaltbaren seRNA-Moleküle im Rahmen eines Entwicklungsauftrags für SRTD weiterentwickeln und für den Einsatz gegen das Glioblastom und weitere Krankheiten optimieren. So soll die neue Plattformtechnologie die präklinische Phase und erste toxikologische Studien nun auch gegen Leberkrebs durchlaufen. Das Einsatzgebiet der Plattform und des neuartigen Baukastenprinzips diverser Funktionalitäten ist breit. Hoffmann ist vom Typ her eher der bedächtige Forscher, der dennoch die vielfältigen Möglichkeiten sieht. Auch in der Forschung könnte die einfache Methode zur Manipulation von Zellen nach Wunsch breite Anwendung finden. So könnte man neben einem Zellkiller auch an andere Funktionen denken, die auf diese Weise einem bestimmten Zelltyp zielgerichtet hinzugefügt werden. Für die Hauptzielrichtung, damit neue, hochwirksame Krebstherapeutika herzustellen, sieht Hoffmann noch einige erforderliche Schritte. Die Sicherheit müsse erst noch ausgiebig getestet werden, meinte er. Der Charme sei jedoch etwa im Vergleich zu CRISPR/Cas und anderen genomeditierenden Technologien, dass man sich sehr viel einfacher die Bestandteile der Zelle zunutze mache und intrazelluläre Eingriffsmöglichkeiten schaffe, die man bisher nicht hatte.
Originalpublikation: Selectively expressed RNA molecules as a versatile tool for functionalized cell targeting, Nature Communications, by Frederik Rastfeld, Marco Hoffmann, Sylvie Krüger, Patrick Bohn, Anne-Sophie Gribling-Burrer, Laura Wagner, Nils Hersch, Carina Stegmayr, Lukas Lövenich, Sven Gerlach, Daniel Köninger, Christina Hoffmann, Helene L. Walter, Dirk Wiedermann, Hajaani Manoharan, Gereon R. Fink, Rudolf Merkel, Heribert Bohlen, Maria A. Rueger, Bernd Hoffmann,
DOI: 10.1038/s41467-024-55547-6

 istockphoto.com/artisteer
istockphoto.com/artisteer Karrrtinki - stock.adobe.com
Karrrtinki - stock.adobe.com NIH.gov
NIH.gov